Impianto
di lipociti
nella retinite pigmentosa
Le basi fisiopatologiche della riabilitazione visiva
Renato Meduri
Direttore della Cattedra di Ottica Fisiopatologica UniversitÓ degli Studi di Bologna
Per
la cura della retinite pigmentosa si è ricorso, fino ad un recente
passato, a numerosi tentativi terapeutici, includenti mezzi sia medici (somministrazione
di vasodilatatori, anticoagulanti, antiaggreganti piastrinici, emoreologici,
ossigeno iperbarico, ozono, vitamine, minerali, ormoni, L-dopa, agopuntura,
ultrasuoni, elettrostimolazione, ecc.), sia chirurgici (impianto sottosclerale
di tessuti placentari, di parti di muscoli extraoculari, ecc.), per la maggior
parte tesi a migliorare l’apporto ematico e il metabolismo retinici:
nessuno si è però rivelato di efficacia consistente.
Risultati molto diversi sono stati ottenuti dall’oftalmologo cubano Palaez
che, con l’intento di migliorare l’apporto ematico corioretinico,
ha eseguito l’intervento di impianto sottosclerale di lipociti orbitar
peduncolati su circa 1600 occhi con RP dal 1993 ad oggi, ottenendo stabilizzazione
della malattia nel 70% dei casi, ampliamento del campo visivo nel 25% e assenza
di effetti apprezzabili nel 5%: tale successo può essere probabilmente
spiegato con le considerazioni che seguiranno.
Essendo la RP una malattia genetica, la terapia ideale consisterebbe nella
sostituzione del gene alterato con quello normale, ma tale soluzione risulta
ancora irrealizzabile; allo stato attuale è però possibile condizionare
i programmi cellulari genetici a mezzo di fattori esogeni: i fattori di crescita.
Il fattore di crescita fibroblastico (FGF) è stato scoperto, come si
intuisce dal nome, per la capacità di indurre la proliferazione di
cellule fibroblastiche. Dalla prima purificazione della molecola da tessuto
cerebrale bovino, si osservò che vi erano due tipi di FGF, molto simili
nelle proprietà biochimiche e biologiche: FGF basico e FGF acidico.
Entrambi gli FGF sono potenti induttori della sintesi di DNA, inoltre, si
è dimostrato, in vitro, che l’effetto mitogeno di tali molecole
su normali cellule diploidi di mammiferi ritarda significativamente la loro
senescenza.
L’espressione di FGF basico è molto ampia e riguarda sia cellule
di tessuti adulti che fetali, nonché linee cellulari tumorali. Più
precisamente influenza la proliferazione della maggior parte di cellule di
derivazione mesodermica e neuro-ectodermica.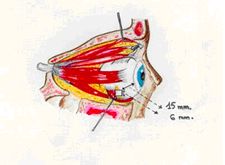
Al contrario l’espressione di FGF acidico è ristretta a cellule
del sistema nervoso centrale e periferico e a cellule endoteliali.
Ulteriori studi hanno messo in evidenza l’attività neurotrofica
di tali fattori (una proteina è considerata neurotrofica qualora permetta
la sopravvivenza di cellule nervose in coltura).
Una caratteristica fondamentale che interessa entrambe le forme di FGF è
l’assoluta mancanza del caratteristico segnale secretorio nella porzione
aminoterminale della catena amino-acidica. Tali molecole infatti non sarebbero
secrete in condizioni normali ma verrebbero rilasciate in condizioni di danno
cellulare.
Per quanto concerne l’occhio, il fattore di crescita fibroblastico basico
esplica effetto di sopravvivenza per i fibroblasti, i fotorecettori (in particolare
i bastoncelli), le cellule bipolari, le cellule amacrine, le gliali di Mueller
e gli astrociti.
Nella retinite pigmentosa del topo è stata dimostrata una carenza numerica
dei recettori di bFGF nelle cellule dell’epitelio pigmentato. In questo
modello l’iniezione intravitreale di bFGF ritarda o previene la degenerazione
dei fotorecettori. Lo stesso effetto del bFGF è stato osservato in
ratti transgenici con mutazione del gene della rodopsina, responsabile del
25-30% dei casi di RP nell’uomo.
Il bFGF possiede però un’azione limitata nello spazio e nel tempo,
cosicché una reale efficacia del trattamento può essere ottenuta
solo con una somministrazione topica continua.
Secondo tali presupposti, l’impianto di un peduncolo vascolarizzato di
lipociti orbitari nel piano sottosclerale trova giustificazione nella considerazione
che detti lipociti, soprattutto quando posti in ambiente eterotopico, liberano
bFGF in maniera continuata o comunque correlata al deficit metabolico tissutale.
Tecnica
chirurgica
Adottiamo la tecnica di Palaez con lievi modifiche concernenti l’ampiezza
dello sportello sclerale e soprattutto una più completa rimozione delle
fibre sclerali profonde.
1. Incisione della congiuntiva per 9 mm sul quadrante temporale inferiore.
Si identifica e apre la capsula di Tenone, quindi si scolla il suo foglietto
viscerale rendendo reale lo spazio soprasclerotico. Evidenziati i muscoli
retti esterno ed inferiore, si passa al di sotto di questi un filo di seta
di 3 – 0 per trazione.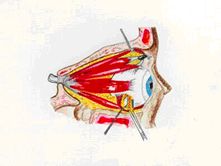
2. Sclerotomia. Localizzata l’inserzione del muscolo obliquo inferiore,
l’emergenza dei vasi vorticosi e il tessuto adiposo vascolare orbitario
sottostante al piccolo obliquo, si realizza uno sportello sclerale tra i muscoli
retti (esterno ed inferiore), 3 mm dietro alla loro inserzione sclerale. La
sclerotomia avrà un’estensione di 6x6 mm. La sclera è incisa
a tutto spessore così da visualizzare la colorazione scura della coroide
e della lamina fusca. È importante che la superficie esterna coroidale
sia libera da tralci sclerali.
3. Peduncolo adiposo. Si isola dal grasso orbitario che emerge di norma al
di sotto del ventre del muscolo obliquo inferiore, un peduncolo adiposo vascolarizzato
di grandezza tale da permettere una completa copertura della superficie uveale
esposta. È importante che la vascolarizzazione del lembo sia ampiamente
rappresentata e che il peduncolo stesso sia sufficientemente lungo da non
creare trazione.
Si sutura il portello sclerale con Vicryl 7/0, avendo cura che i fili di sutura
ancorino il lembo fibro-adiposo. Al fine di evitare compressione del peduncolo,
è opportuno creare nel punto del suo ingresso sotto il portello sclerale
un ostio che lo contenga.
Si sutura quindi l’incisione congiuntivale.
Bibliografia
1. 1 . Pelaez, 0.: Retinosis
pigmentaria. Experìencia cubana Editorial Cientifico Técnica.
La Habana, 1997.
2. Burgess W. Maciag T. (1989): The heparin binding (fibroblast) growth
factor family Ann. Rev. Biochem. 575-606.
3. Abraham J., Whang J.: Human basic fibroblast growth factor: nucleotide
sequence and genomic organisation EMBO J 2523-8 (1986).
4. Mascarelli F., Raulais D., Courtois Y.: Fibroblast growth factor phosphorylation
and receptors in rod outer segments IENBO J. 8: 2265-2273 (1989).
5. Sensenbrenner M.: The neurotrophic activity of fibroblast growth factors.
Progress in neurobiology vol 421, pp683-704 (1993)
6. Morrison R.S., Sharma A.: bFGF supports the survival of cerebral cortical
neurons Mì primary colture.
7. Sak-aguchi D.S., Janik L.M., Reh T.A.: Tasic fibroblast growth factor
induced transdifferantiation of retinal pigment epithelium: generation of
retMial neurons and glia Dev Dvn 1997 Aug; 209(4): 387-98.
8. Barritault D. et al.: Purification, charactenrization and biological
properties of the evederived grow-th factor from retina: analogies with brain-derived
gaTowth factor J Neurosci, Res 477-490 (1982).
9. Gargini C., Belfiore M.S., Bisti S., Cervetto L., Valter K, Storie J.:
The impact of basic fibroblast growth factor ori photoreceptor fimction
and morfology Invest Ophthalinol Vís Sci 1999 Aug; 40(9): 2088-99.
10. LI ZY, Chang J.H., Milam A.E.: A gradient of in rod photoreceptors
in the non-nal human retina Vis Neurosci 1997 Jul - Aug; 14(4): 671-9.
11. Malecaze F., Mascarelli F., Courtois Y., Mathis A., Hicks D. Recepteurs
au facteur de croissance des fibroblastes et retinopathie pigmentaire.
Oplitalmologle 1992; 6: 170173.
12. Fak-torovich E.G., Steinberg R.H., Yasumura D., Matthes M.T., LaVail N.M.
Photoreceptor degeneration in inherited retina dystrophy delayed by basic
fibroblast growth factor Nature. 1990;)47:8-)-6. 11 Steiribera RH., et
al. Slowing by survival factors of inherited retMial degenerations in transgenic
rats with mutant opsin genes. Invest. Ophthalmol. Vis. Sci. 3 ) 8: 5226.